Човечеството се намира в непрестанна битка с бактериите, които определено могат да ни избият, но от десетилетия антибиотиците са единствените ни оръжия срещу тях. Те преобразиха медицината през 20-ти век, а заедно с ваксините доведоха до почти сигурното унищожение на някои инфекциозни заболявания в развиващия се свят.
Но въпреки невероятният успех на антибиотиците, някои резистентни бактерии бавно печелят войната. Всяка година все повече хора умират от резистентни към антибиотици бактерии, което ни доближава до дните преди появата на пеницилина. Ефективността им и лесният достъп доведе до свръх използване, особено в сферата на животновъдството. Това накара Световната здравна организация да класифицира антибиотичната резистентност като „сериозна заплаха, която вече се наблюдава навсякъде по света и има потенциала да засегне всеки, на всяка възраст и от всяка държава.“
Отговорността за тази ситуация е споделена между много участници: лекари; пациенти, които искат антибиотик против грип; правителствата, които не стимулират проучванията на нови класове антибиотици; фармацевтичните компании, които търсят просто печалба.
Но не е от значение кой точно е виновен, защото бяхме обречени да ни сполети настоящата ситуация. Когато целта е да убием организъм, резистентността, противопоставянето са неизбежни. Така работи природата – естествен отбор. В този случай антибиотиците убиват всички чувствителни бактерии, но няколко резистентни към медикамента оцеляват и евентуално се размножават. Привидно унищоженият проблем се завръща по-силен от преди.
 Така животът отговаря към стресови фактори. Той се адаптира. Този феномен е виден и в растителното царство. Нека погледнем към дебата относно резистентните към хербициди плевели. Без значение дали земеделец ще използва органични хербициди, конвенционално отгледали култури или модифицирани, резистентни към глифозат сортове, мутантните плевели оцеляват, адаптират се и създават супер семена. Това е законът на природата. Да, можем да сменим хербицидите или да създадем нови, но процесът ще започне отново и отново. Това се отнася и за антибиотиците. Дори да създадем нов клас антибиотици, резистентността ще настъпи евентуално, без значение колко отговорно ги използваме.
Така животът отговаря към стресови фактори. Той се адаптира. Този феномен е виден и в растителното царство. Нека погледнем към дебата относно резистентните към хербициди плевели. Без значение дали земеделец ще използва органични хербициди, конвенционално отгледали култури или модифицирани, резистентни към глифозат сортове, мутантните плевели оцеляват, адаптират се и създават супер семена. Това е законът на природата. Да, можем да сменим хербицидите или да създадем нови, но процесът ще започне отново и отново. Това се отнася и за антибиотиците. Дори да създадем нов клас антибиотици, резистентността ще настъпи евентуално, без значение колко отговорно ги използваме.
В този ред на мисли термини от сорта „супер бактерии“ или „супер плевели“ са неточни, защото тези организми не са специални по никакъв начин. Те правят точно това, което природата им е отредила.
Това, което изправя антибиотиците пред изпитание е, че бактериите изглежда могат да развият резистентност много по-бързо от който и да е друг организъм. Конюгацията (полов процес при бактериите) позволява на микроорганизмите да споделят гените си за резистентност не само с членове на същия вид, но и между индивиди от различни видове, дори между грам положителни и грам отрицателни. Това се нарича хоризонтален генетичен трансфер и позволява да се разпространяват белези, които носят предимство, между индивиди от едно поколение. Освен това има доказателства, че в условия на наближаваща фатална заплаха бактериите ускоряват честотата на мутиране, за да се опитат да придобият резистентност към приближаващата опасност.
Време е да преминем отвъд ерата на антибиотиците.
Фагова терапия
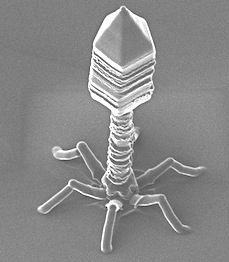 Това, от което имаме нужда във войната против микробите са агенти, които са ефективни, но и по-видово специфични. Една от изучаваните стратегии е да се използва естествения им враг – фаги (вируси). С други думи – врагът на моя враг е мой приятел.
Това, от което имаме нужда във войната против микробите са агенти, които са ефективни, но и по-видово специфични. Една от изучаваните стратегии е да се използва естествения им враг – фаги (вируси). С други думи – врагът на моя враг е мой приятел.
Вирусите не инфектират само хора, всъщност всеки вид има определен брой вируси, които могат да го инфектират. Учените наричат бактериофаг всеки вирус, който инфектира бактерия. Подобно на човешките вируси, фагите придобиват контрол над вътрешността и всички молекулни „машини“ в бактерията. Целта е да се създадат огромен брой нови вирусни копия. В определен момент броят на вирусните копия карат клетката да се разкъса и да освободи множество вирулентни единици, които да инфектират други бактериални клетки. Другият вариант е периодично отделяне на вирусни частици без унищожаване на клетката.
Този процес може да се манипулира за целите на хората. Работата с фаги датира от времената на Студената война. Докато САЩ са изследвали антибиотици, СССР са развивали това, което сега е познато като „фагова терапия“. В някои от бившите съветски републики тази терапия все още се използва.
Едно от основните предимства на този метод на лечение е, че фагите са високо специфични и не инфектират човешки клетки или други бактериални видове. В по-голяма част от случаите бактериофаг, който атакува клетки на E. coli няма да инфектира други видове, като коменсалните Staphylococcus. Има дори доказателства, че фагите имат специфичност към щамове, което означава, че можем да създадем бактериофаг, който преференциално ще инфектира опасни щамове E. coli, докато остава непокътнати непатогенни представители (1).
Друго предимство е, че вирусите се самовъзпроизвеждат. Един фаг, който инфектира единична клетка ще продуцира хиляди нови копия, които ще убият още повече бактерии. Има известен проблем. Вирусите ще доведат до разкъсване на бактериалните клетки, което би могло да освободи интрацелуларни токсини (ензими или липидни комплекси), което да доведе до сепсис.
Но изследователите вече работят по решение на този проблем. В MIT (2) са създали„фагмиди“ – инженерни фаги, които носят плазмиди, а не цял геном. Плазмидите са малки фрагменти кръгова ДНК, която носи малък брой гени, които кодират вирулентни фактори и/или носят гени за антибиотична резистентност. Когато бактериите пристъпят към конюгация, започват да си предават именно плазмиди. При фагмидите плазмидът води до убиването на бактериалната клетка, но без да последва лизис – разкъсване. Липсата на лизис означава, че вътрешните токсини няма да се освободят в тялото. Вече има наблюдаван успех при лечението на мишки.
CRISPR-CAS9
Редактирането на гени чрез CRISPR-CAS9 също може да се използва за борба с бактериите. Ако бактериите оцелеят след инфекция с фаг, те запазват малка част от вирусния геном. Бактериите в последствие експресират (синтезират) тези малки фрагменти като РНК секвенции, които са комплементарни на части от фаговия геном. В клетката тези ДНК секвенции се асоциират с ДНК режещ протеин (CAS9), който реже фаговия геном, което го инактивира.
 Но любопитното при CRISPR-CAS9 е, че могат да бъдат създадени всякакви РНК секвенции дори такива, които са комплементарни с гените за антибиотична резистентност. Група от Университета в Тел Авив са създали CRISPR-CAS9 система, която се прицелва в бета-лактамазния ген. Този ген продуцира ензим, който инактивира широк спектър от антибиотици – пеницилин, цефамицин, карбапенеми (3).
Но любопитното при CRISPR-CAS9 е, че могат да бъдат създадени всякакви РНК секвенции дори такива, които са комплементарни с гените за антибиотична резистентност. Група от Университета в Тел Авив са създали CRISPR-CAS9 система, която се прицелва в бета-лактамазния ген. Този ген продуцира ензим, който инактивира широк спектър от антибиотици – пеницилин, цефамицин, карбапенеми (3).
CRISPR секвенцията и CAS9 протеинът ще бъдат доставени в бактериите чрез модифициран фаг, а техниката е ефективна за прицелване на хромозомни и плазмидни гени. До този момент техниката е използвана за премахване на резистентността на бактериите към обикновени антибиотици, но не е извън границите на възможното системата да се използва за премахване на важни бактериални гени, което би превърнало техниката в бактерицидна.
Използването на фаги, фагмиди и CRISPR ни дава по-сложни и насочени методи за лечение на инфекции. Но тези методи не трябва да се смятат като магически куршум, защото именно по този начин стигнахм
е до настоящата ситуация с антибиотиците. Резистентност към тези техники ще настъпи. Неизбежно тези организми ще се адаптират.
Резистентност към CRISPR-CAS9 вече е документирана при някои видове. Бактериите също ще развият CRISPR-CAS9 системи с памет, които ще се преборят с инженерните фаги. Това не е причина да загърбим тази технология. Така ще научим как бактериите ще реагират и ще се адаптират към методите ни. Ще можем да използваме тази информация за контраатака.
Един начин да избегнем (макар за малко) появата на резистентност е да създадем множество бактериофаги, които са напълно различни генетично един от друг (множество фаги с различни таргетни секвенции) и да използваме този коктейл за лечение на пациенти. Шансовете бактериите да развият резистентност към един фаг са големи, но шансовете да развият едновременно резистентност към множество фагови щама по време на инфекцията е малък. Но ако това се случи, резистентният щам вече ще може да се нарече „супер бактерия“.
2) http://pubs.acs.org/doi/abs/10.1021/acs.nanolett.5b01943
3) http://www.the-scientist.com/?articles.view/articleNo/42992/title/Targeting-Antibiotic-Resistant-Bacteria-with-CRISPR-and-Phages/






